| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Електронний |
 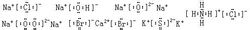 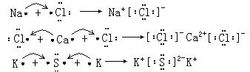  |
|
Визначення В результаті хімічної реакції, як правило, змінена атомів. Для простоти, хімічної часто чорні плями оточенні елемент символ "". Або невеликий вилка "×" вказує, що елемент зовнішнього електрона атома, відповідний вираз називається електронним.Може бути виражена електронних атоми, іони, молекули елементарного може бути виражена ковалентні сполуки, іонних сполук і освіта. Створення електронних слід зазначити: 1, незалежно від частинок, які складаються з атомів електронних компонентів в якості основної одиниці, і не може навіть здатися, Кутовий коефіцієнт. (2) різних атомних часток, що складаються з різних електронних, має бути однорідним і симетричним. Стабільний 8 електронної структури зазвичай виражається у вигляді чотирьох пар електронів (зазвичай символ для елемента, нижній, лівої і правої парою електронів). 3 середні школи, щоб дізнатися класичної 8-електронних кутку тіло належить застарілої теорії, лише мала частина використовується для представлення основних елементів формування груп речовин, не може бути представлена перехідним елементом формування речовин. Як показано на наступному більш поширеним хімічним речовинам, електронні абсолютно не в змозі пояснити: O2 (трехцентровимі два π облігацію), озон (три-чотири центри π-електронного зв'язку); супероксид (три π-електронного зв'язку); Озоніди (п'яти трехцентровимі електронів π облігацію), вуглекислий газ, закис азоту, азид Коренева N3-(три-чотири центри π-електронного зв'язку) ...... і так далі. Тому ми говоримо, що чим більше електронних обмежень, лише невелика частина представлення структури речовини. Але реальний сенс структура не використовується електронна формула. Сполуки Ковалентні з'єднання електронні листи, основний молекулярної ковалентного одна речовина так само, як ті, які зазвичай позитивні ціну спочатку. Для різних атомних елементів валентності, зазвичай валентність написаний у середині велике абсолютне значення, невелике абсолютне значення, записане на периферії. Наприклад: Іон Іонні з'єднання електронні листи, щоб іони (катіони фронту, аніони на цій посаді.) Частини разом. Для різних валентних іонів відповідно до їх абсолютні значення, у відповідності з "великим значенням в середині, малих значеннях оточуючих" принцип письмовій формі. Наприклад: Іон Концепція іонної зв'язку та аніону катіон хімічних зв'язків формується за рахунок електростатичних взаємодій. У зв'язку іонного з'єднання називається іонну сполуку. Ковалентний Концепція ковалентний зв'язок між атомами частка електронів через утворення хімічних зв'язків. Утворення ковалентного зв'язку на з'єднання являє собою ковалентні сполуки. Іонні з'єднання всіх атомів ковалентно. Атом Атоми елементів, заснованих на кількості число зовнішніх електронів, спочатку з чорні плями "·" (або "×") елемент символи, такі як символи, вниз, вліво і вправо показує один електрон, додаткові спарювання електронів . Елементний молекул Повинні бути правильно висловив загальні електронні пари і зустріти кожен атом стабільної структури. Іон 1 Катіон: прості катіонів за рахунок формування зовнішнього електрона, яка була втрачена, так що електронні позначення її іон сам символ. Наприклад: Na , K , Mg2 , Ca2 , Ba2 , Al3 . Комплексні катіони (наприклад, NH 4 H 3 O і т.д.), на додаток до зазначеного неподіленого пари електронів, неподіленої електронної парою триває, повинні бути додані в дужках і відзначені у верхньому правому іонний заряд дужках. Аніону 2: Чи є це простим аніон або комплексного аніона повинні бути відзначені електронних пар і т.д., повинні бути додані в квадратних дужках і відзначені у верхньому правому іонний заряд дужках. Наприклад: атом втрачає електрони стає катіонні, аніонні атомі електрони прибутку стає. Atom, ядерний заряд число = число протонів = кількість позаядерними Особливі обставини NaOH є винятком, в його хімічна формула, містить як іонний зв'язок також включає в себе ковалентного зв'язку. Однак, так як він містить іонним зв'язком, тому ми називаємо такий клас, як NaOH двох зв'язків є іонними з'єднаннями, що містять речовини Тут ми повинні звернути увагу, CO2 чи не пояснюється електронним сполук формули (є великий ключ фракції), вторинна структура для опису CO2 абсолютно неправильно. Оскільки експерименти показують, що вуглекислий газ CO довжини зв'язку між окисом вуглецю (як правило, потрійний зв'язок) з карбонільної групою (подвійний зв'язок), з яким електронному вигляді не може бути пояснено. Нижче наводиться правильний опис структури діоксиду вуглецю: молекул СО2 в атомі вуглецю використовує зр гібридної орбіталі зв'язку з атомами кисню. З-атомами, два зр гібридних орбіталей і двох атомів кисню, відповідно, щоб генерувати два σ зв'язком. З атомом два не брав участі в р орбітальної гібридизації з SP гібридних орбіталей під прямим кутом, і атоми кисню з боку с р орбітальної перекриття пліч-о-пліч, відповідно, для створення двох Π трехцентровимі четирехелектронних делокалізацією ключ. Тому зменшення вуглецю - відстань між атомами кисню, вуглець-кисень у CO2 потрійну зв'язок з певним характеристика ступеня. |
| Користувач Огляд |
|
Немає коментарів |