| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Каталіз |
  |
|
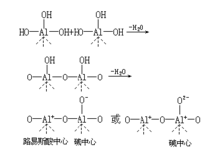
Каталізатор в хімічних реакціях. У каталітичної реакції каталізатор і реагент хімічна реакція відбувається, зміна шляху реакції, тим самим зменшуючи енергію активації, що збільшує швидкість реакції каталізатор може бути причиною. Такі, як хімічна реакція A B → AB, необхідною енергією Е активації додаванням каталізатора С, реакцію проводили у два етапи.Каталітичний принципі C → AC AC B → AB C Цей двохстадійний енергія активації значно менше, ніж значення E. Згідно з формулою Арреніуса к = Ae-E/RT, так як каталізатора в реакції до значення E зменшується, так що швидкість реакції значно збільшена. Існують також деякі реакції, каталізатор в реакції, енергія активації Е значень змінилася, але предекспонента була значно збільшена (або інтерпретувати як активація ентропія), але також призвели до швидкості реакції. Каталітичний типу Каталізу можуть бути розділені на наступні типи: ① гомогенного каталізу. Каталізатор і реагенти знаходяться в одній фазі каталіз, наприклад, однорідні кислотно-основного каталізу, однорідний каталізу. Більшість гомогенного каталізу в рідкій фазі. Активний центр гомогенного каталізатора щодо однорідної, високу селективність, менше побічних ефектів, важко відокремити каталізатор, переробки та регенерації. ② гетерогенного каталізу. Сталося в двофазної каталіз на інтерфейсі. Зазвичай каталізатор являє собою пористі тверді, рідкі або газоподібні реагенти. У гетерогенних каталітичних реакцій, твердий каталізатор в хімічній реакції адсорбції молекул, молекули, які активують реагентів, зниження енергії активації, в результаті чого швидкість реакції прискорюється. Твердої поверхні каталізатора нерівномірно, тільки деякі моменти реагентів хемосорбірованние молекул, називають активним центром. Каталіз в промисловому виробництві в основному гетерогенного каталізу. ③ біокаталізу. Vivo під дією ферменту-каталізуються реакції. Ферментативний каталіз з високою селективністю, високою каталітичної активністю, м'яких умовах реакції і т.д., але по температурі розчин рН, іонна сила більший ефект. ④ автокаталітіческіх. Автокаталитического продукту реакції. У деяких реакцій, деякі з продуктів реакції або проміжні сполуки, що мають каталітичну функцію, реакція після значно прискореному темпі після індукційного періоду. З моменту виявлення хімічного каталізу є необхідною умовою для коливань. Інші включають в себе електро-каталітичні, фотокаталітичний, фотоелектричні каталізу ...... Кислотно-основний каталіз План Англійська назва: кислотно-основний каталіз Кислоти як каталізатора в якості каталізатора. Молекул реагентів в контакт з кислотою, або адсорбовані на поверхні каталізатора кислотних центрів на твердому, кислотно-лужної реакції відбувається, з утворенням активного проміжного комплексу, а потім розкладання продукту, каталізатор відновлюється. Категорія ① гомогенного каталізу кислоти: основний гідроліз і гідратації, конденсації етерифікації, алкілування, перегрупування, (в основному, рідка фаза). Так, наприклад, сірчаної кислоти каталізатор етилену гідратований етанол; епіхлоргідріна під дією каталізатор гідроксид натрію, гідроліз гліцерин, бензол і галогеновані трихлорид алюмінію в якості каталізатора, алкільну групу . ② гетерогенному каталізі кислотою: основний полімеризації олефінів, каталітичний крекінг, изомеризацию олефінів та парафінів, конденсації того, диспропорционирования тощо (каталізатор є тверда фаза). Так, наприклад, алканів REY цеоліту та (або) алюмосилікатний гель FCC бензин і С3, С4 газу; бензолу і етилену алкільну групу на твердій фосфорної кислоти в етилбензол; олигомеризации пропілену по сульфату нікелю; олефінів тверду основу (натрію або калію) і т.д. катализируемой димеризации. Деякі катализируемой кислотою реакції також може бути катализируемой підставою, тільки продукти не є ідентичними. Наприклад, моноалкенільного ароматичного вуглеводню і катализируемой кислотою реакції продукт був доданий в ароматичне кільце, що генеруються на основі каталізу бічного ланцюга алкилірованіє ароматичних сполук. В іншому прикладі кислоти або основного каталізатора, олефін може статися цис-транс-ізомеризації і реакції ізомеризації подвійний св зи, але тільки при кислотному каталізі все ще може статися скелетної ізомеризації. ③ Бренстеду кислотного каталізу ④ Льюїса кислотно-основного каталізу Класифікація за Catalyst Якщо каталізатор є кислотою або кислотою центр, реагент молекула повинна містити легко приймати протон або пару електронів даного атома або групи, якщо каталізатор підставою або лужного центр може бути легко даного реагенту протонів молекули або приймати електронні пару. Крім того, для різних каталітичних реакцій, молекул реагентів на поверхні каталізатора адсорбційної здатності і каталітичної активності каталізатора з кислотно-основні властивості також варіюється. Кислота каталізуються реакції до певного типу кислотних центрів і можуть вимагати певного діапазону концентрації кислоти. Кислотно-основний каталіз у однорідною або гетерогенний каталіз каталізу в обох додатках, є найбільш поширеною рідкої фази каталітичного каталітичних застосувань в хімічній промисловості дуже широкий. Твердих центр кислоти Є два типи твердих кислот і підстав твердих кислотних центрів: кислоти Льюїса центри та центри кислоти Бренстеда, на додаток до лужних центру. В якості кислоти Льюїса центрів молекули як кислоти Льюїса, з незайнятим орбіталь електрона на більш високий спорідненість до електрону. У центрі підстави Льюїса з рівнем енергії електронів, а якщо вона є, і акцептора електронів адсорбований тільки це дві пари електронів, то енергія буде знижена. Бренстеда кислотних центрів мають тенденцію до випуску протона. Різноманітність твердої кислотою, такий як рідина, що міститься в твердому кислота, оксиди металів (наприклад, оксид алюмінію, оксид магнію, оксид титану, оксид цинку), сульфіди (наприклад, сульфід цинку, сульфід кальцію) і хлорид (хлорид хлорид ртуті, хлорид міді, хлорид алюмінію), змішані оксиди (наприклад, оксид алюмінію - діоксид кремнію, оксид кремнію - оксид магнію), цеоліт і метал сульфат, фосфат тощо. Є глинозем, цеоліт видалення катіонів ілюструють кислоти Льюїса, Бренстеда, кислот і підстав, відповідних причин центрів. Глинозем нагрівається зневоднення гідратованих оксидів створювався: Цей простий абсорбувальний стає кислоти Льюїса центри кислоти Бренстеда сайтів: |
| Користувач Огляд |
|
Немає коментарів |