| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Молярної електропровідності |
  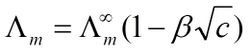 |
|
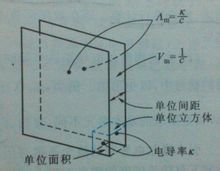
Визначення Молярна електропровідність Ат (молярної електропровідності) відноситься до Розчин поміщають в електроліт, що містить 1 моль одиницю відстані один від одного як осередок провідності між двома паралельними електродами, тобто провідність. [1]Формула З-за різних електролітів були взяті 1 моль, але обсяг розчину прийняті Vm зміниться з концентрацією. Нехай з собою концентрацію розчину електроліту (в моль • м-3), розчин електроліту, що містить 1 моль Vm рівний об'єм 1 / с, відповідно до визначення провідність κ, до молярної провідності і електропровідність між ХМ співвідношення виражається формулою Ат = K · Vm = к / с Де до одиниць S · м-1, з одиницями моль · м-3, так що молярної електропровідності Ат одиниць S · м2 · моль-1 [1] Значення Концепція впровадження молярної електропровідності корисно. Провідність електроліту, оскільки в загальному випадку не занадто сильним, як із збільшенням концентрації і стає великим, провідних частинок збільшений. Для того щоб полегшити різні типи провідності електроліту порівняння його часто використовують в молярних провідність, тому що тоді не тільки мають таку ж кількість електроліту (електроліт містить 1 моль), а відстань між електродами також одиницю відстані. Звичайно, у порівнянні з обраним заряду електроліту елементарних частинок повинен бути таким ж кількість заряду. [1] Зв'язок Коли концентрація знижується, послаблюючи взаємодія між частинками, позитивний і негативний швидкість міграції іонів швидкості, молярна провідність розчину будуть рости. Однак різні електроліти, молярна провідність зростає із зменшенням ступеня концентрації також дуже різними. Коли концентрація знижується до певної міри, сила молярної провідності електроліту близька до постійної величини, але значення все ще слабка електроліт продовжують змінюватися. [1] Якщо в тому ж діапазоні концентрацій порівняти різні значення молярної електропровідності зміни, наприклад, на NaCl, H2SO4, CuSO4 порівнюються один з одним, ви знайдете, коли зниженні концентрації кожного значення молярної провідності змінити в різному ступені. Найбільше зміна CuSO4, H2SO4, а потім мінімальні зміни в NaCl. Це тому, що 2-2 валентних типу солей тяжіння між іонами великий, коли концентрація змінюється, більший вплив на електростатичне тяжіння, тому значення молярної провідності змінити. Як правило, коли концентрація сильних електролітів 0.001mol · дм-3-менш, ХМ √ С і лінійну залежність між концентрацією с і між ХМ наступному співвідношенню: Де β при певній температурі, електроліт і розчинник для даної мети є константою. Ат (∞) у вигляді розчину в нескінченному розведенні молярної електропровідності, також відомий як граничні молярні провідності. [1] |
| Користувач Огляд |
|
Немає коментарів |