| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Ацетальдегід |
 |
|
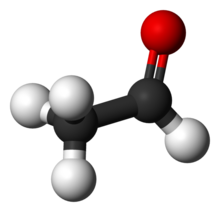
Технологія Визначення Китайська назва: ацетальдегід Англійська назва: ацетальдегід Визначення: MF як "СНТ", 7 атомів.Прикладна наука: Астрономія (об'єкта); міжзоряних молекул (два суб'єкта) Вище утримання Національного комітету науки і технологій оголосив затвердження Китайська назва: ацетальдегід На ім'я іноземця: ацетальдегід Ні CAS :75-07-0 ЕІНЕЦС: 200 -836-8 Молекулярна формула: C2H4O Проста структура: CH3CHO Псевдонім: альдегіди Ацетальдегід являє собою альдегід, риса представляє собою безбарвну рідину рідина з різким запахом. Температура плавлення -121 ℃, температура кипіння 20,8 ℃, відносною щільністю менше 1. Розчинні у воді і етанолі і деяких інших органічних речовин. Легкозаймисті пари і повітря може утворювати вибухонебезпечні суміші вибуху межа 4,0% ~ 57,0% (за об'ємом). Короткий вступ Ацетальдегід (оцтовий альдегід) альдегіду. Також відомий як альдегіди, безбарвна, рухома рідина з різким запахом. Температура плавлення -121 ℃, температура кипіння 20,8 ℃, відносна щільність 0,7834 (18/4 ℃), температура спалаху (у відкритому тиглі) -7,22 - 9,44, відносна молекулярна маса 44,05, зазвичай на 40% водного розчину, молекулярна структура метил атомів вуглецю sp3-гібридні орбіталі, альдегід З атомами SP2 гібридні орбіталі (-СНО), молекули полярних молекул. Розчинні у воді, спирті, ефірі, хлороформ, ацетон і бензол. Легкозаймисті, летючі. Пари і повітря утворює вибухонебезпечні суміші вибуху межа 4,0% ~ 57,0% (за об'ємом). Легко окислених з оцтової кислоти. У присутності невеликої кількості кислоти дуже легко агрегувати в паральдегід (рідина, температура плавлення 12,6 ℃), низькотемпературний поли генеруються ацетальдегіду. Ці два полімеризації під дією фізичної в невеликій кількості сірчаної кислоти розкладання ацетальдегіду. У великих промислових ацетилену високої каталітичної гідратованих солей ртуті генеруються; новий метод виробництва міді, хлористий етилен - хлориду паладію каталізують пряме окислення з повітрям. В основному для виробництва оцтової кислоти, етилацетату і оцтовий ангідрид використовують у підготовці пентаеритрит, кротональдегід, кротоновий кислоти і хлоралгідрат. Молекулярна структура: Важливими властивостями Промислові рівняння ацетальдегід Виробництво: 2CH ₃ CH ₂ OH O ₂ → 2CH ₃ СНТ 2 H ₂ O (нагрівається каталізатор Cu / Ag) Методом гідратації ацетилену: C ₂ H ₂ H ₂ O → CH ₃ СНТ (каталізатор, опалення) (є доповненням реакції, а й реакція відновлення) Окислення етилену: 2CH ₂ = CH ₂ O ₂ → 2CH ₃ СНТ (каталізатор, опалення, тиску) Окислення ацетальдегіду: 2CH ₃ СНТ O ₂ → 2CH ₃ COOH (каталізатор, опалення) Ацетальдегід згорання: 2CH ₃ СНТ 5 O ₂ → 4H ₂ O 4 CO ₂ Срібне дзеркало реакції: CH ₃ СНТ 2 Ag (NH ₃) ₂ → OH CH ₃ COONH ₄ Ag 2 3 NH ₃ H ₂ O (опалення) Ацетальдегід і свіжоприготованого гідроксиду міді: CH ₃ СНТ 2 Cu (OH) ₂ → CH ₃ COOH Cu ₂ O 2 H ₂ O (опалення) (Cu ₂ O покоління цегляно-червоний осад) Етанол, ацетальдегід і водень реакція реакції приєднання: CH ₃ CHO H ₂ → CH CH ₂ ₃ ОН Фізичні та хімічні властивості Основні інгредієнти: чистий |
| Користувач Огляд |
|
Немає коментарів |