| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Кулонометричне титрування |
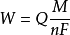     |
|
Також відомий як постійний струм кулонометрического титрування, заснований на контрольованому поточного процесу електролізу на основі кулонометрия. Принцип З силою деякий постійний струм через електролізер, в той час як електричний дзвінок запису. Оскільки електродної реакції в безпосередній близькості від робочого електрода продовжують продукують речовина, яка в розчині реагують з випробовуваним речовиною. Коли досліджувана речовина "титрування" (реакція) не буде зроблено, до кінця реакції індикаторний прилад подається негайно зупинити електроліз, вимкнути електричний годинник. Відповідно до закону Фарадея, шляхом електролізу т часу та інтенсивності струму я розрахунку маси випробуваного розчину W:Де: Q є потужність, споживана електродної реакції (Q = I · т); Μ є молекулярна маса досліджуваної речовини, N-число електронів електродної реакції передачі. F є постійною Фарадея (значення 96485C/mol) [1] Обладнання Кулонометрического титрування пристрої постійного струму електролізера (рис. 1, е електрода). Струм через електролізер по точності показує гальванометр G, а й прецизійний потенціометр резистором стандарти виміру напруги й шукати. Електролізер має дві пари електродів (2), кінець електродної пари позначений; інша пара вимірювальних електродів кулон, який вступає в реакцію з речовиною повинна бути виміряна з робочим електродом, електродом, а інший зазначеного допоміжного електрода. Для того щоб запобігти взаємні перешкоди між двома електродами, допоміжний електрод зазвичай встановлюється в скло, що містить, межує з пористим дном кожуха підставу, на верхній шар агару або силікон, або втулки закриті іонообмінної мембрани, щоб запобігти іонів з . Де можна вказати загальну електроенергії шляхом титрування, кулонометрического титрування може бути використаний для вказівки кінця. Вказується кінці методу Індикатор методу Визначення гідразин, наприклад, електролізер з гідразином і безліч броміду калію, метиловий оранжевий, як показник реакції електрода: Катод: 2Н 2е ─ → H2 анода: 2Br-─ → Br2 2e Br2 і електрода в результаті реакції з розчину гідразину: NH2-NH 2 2 Br2 ─ → N2 4 HBr Надмірне окислення Br2 зробить його зникати індикатор, який вказує на кінець. Зупинити електроліз, струму і часу розрахунків з розчину гідразину змісту. Потенціометричний Визначення концентрації розчину кислоти з використанням скляного електрода і каломельний електрод в якості індикатора рН-метра електрода вказує кінець. Надзвичайно негативний платина робочого електрода, срібло надзвичайно допоміжний електрод. Електрод реакції: Катод: 2Н 2е ─ → H2 Негативний: 2Ag 2 Cl-─ → 2AgCl 2e У процесі електролізу, кислотність розчину знижуються. На рН за допомогою рН-метра показує різке збільшення в кінці. Цей принцип може бути визначена з використанням методу еталонного матеріалу і калій водень фталат чистоти, кілька точність відсотків. Повна зупинка кінцева точка методу З двома платиновими електродами (рис. 3) e1, e2 якості індикаторного електрода. У наведеному вище плюс невелика напруга (50 мВ або трохи більше), і лінія в серії чутливого гальванометра G. Щоб струму через електролізер, зниження платинового електрода реакції має відбуватися, інший окислення платиновому електроді відбувається реакція. Якщо рішення у той же час є окислювально-відновний оборотної окислювально-відновної окислення і зниження держав (наприклад, Fe 3 і Fe 2 ; Br2 і Br-), його полярографическая кривої, зображеної на малюнку 4а, просто додайте невелику напругу ΔE, може зробити окислення відновлюється на e1, e2 на стан окисно-відновний, струм тече через електролітичну комірку. Якщо рішення у присутності окисленого і відновленого держави не належать до тієї ж електричної правом влади з боку двох [такі як H і As (Ⅲ)], то, коли полярографічних кривої, зображеної на малюнку 4б. Щоб струму через електролізер на Фіг.3, щодо велика напруга не потрібно. При додаванні до розчину 3 As (Ⅲ) та бромід натрію, а потім титровали зі стандартним розчином брому As (Ⅲ). У розчині до точки еквівалентності, а не тільки Br-Br2, змінивши сторони не існує, коли прикладена напруга 50 мВ, так що струм через електролізер немає. Трохи більше кінцевої точки титрування, рішення як Br-там Br2, прикладена напруга мало, тобто відбувається електроліз стрілка гальванометра упередженим партії, із зазначенням точки титрування кінця. Хоча рішення під час титрування (Ⅲ) і As (Ⅴ), але в умовах експерименту, два не є оборотними електричними правом, тому не може грати роль оборотної окислювально-відновної пари. Використання мертвої точки кулонометрического методу кінцевої точки титрування вказує кінець прикладом є використання електроліз для отримання Br2 титрування As (Ⅲ). Потім кулонівських електролітичної комірки є двома робочими електродами платинових електродів. Містять As (Ⅲ) додавали сірчану кислоту і бромід натрію, електродні реакції: Катод: 2Н 2е ─ → H2 Позитивний: 2Br-─ → Br2 е Два індикатори електродів E1, E2 і схемі, показаної на малюнку 3. Платиновий отримують електролізом Br2 рішення титрування рівні (Ⅲ). Гальванометром G позначення кінця. Статус-кво Кулонометричне титрування є найбільш точним методом постійного аналізу, але і високочутливим методом для визначення слідових компонентів. Через часу і поточного може бути точно виміряна, кулонометрического титрування дуже високою точністю, точність визначення постійної складової, як очікується, досяг двох дуже мало. Цей метод може бути застосований до ситуації, в яких, порівняно із загальним аналізом потужності вище. Для цього не потрібно підготувати стандартні рішення, і, отже, немає жодної проблеми зі стабільністю стандартних рішень. Це не вимірюють обсяг, не було ніякої помилки в цьому відношенні. Це більш імовірно, ніж у загальній автоматизації констант. У кулоновском електролітичної осередку, титранта породжених електролізу є: Н , ОН-, Cl2, Br2, I2, Ce (Ⅳ), Ti (Ⅲ), Fe (Ⅱ), Mn (Ⅱ), Ag (Ⅰ), Fe (CN) Ши, Fe (CN) Ван, CuBr розваги, Sn (Ⅱ) і так далі. Вони можуть титрування багато неорганічних і органічні речовини. Кулонометрического титрування аналіз цих найкраще підходить для використання в якості основного стандартного аналізу об'ємних хімічних реагентів. |
| Користувач Огляд |
|
Немає коментарів |