| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Фосфін |
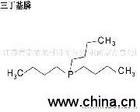 |
|
Фізичні властивості Зазвичай відноситься до фосфін (PH3). При кімнатній температурі, фосфін є безбарвний, дуже отруйний газ із запахом часнику. Температура плавлення фосфін 140K, температура кипіння 185.3K.Хімічні властивості Піньінь: Лін. "Фосфін" також відноситься до Сполученим фосфін (P2H4). Сполучені фосфін пл 174.2K, температура кипіння 328.2K. Вище кімнатної температури, Сполучені фосфін буде розкладатися при контакті з повітрям відразу ж стріляти. PH3 спосіб попередньої підготовки: 1) фосфід металу реагує з водою, 2) білого фосфору і лужної розчин (30%) ефект. Ca3P2 6 H2O ==== 3Ca (OH) 2 2 PH3 ↑; P4 NaOH 3 3 H2O ==== PH3 ↑ 3 NaH2PO4 PH3 є високотоксичним газом, повітря максимально допустиму кількість 0.3ppm. PH3 газу доступні Дихромат хромової кислоти, срібло, вуглець, поглинаючий розчин відбілювача. Трасування PH3 доступні силіконові чорні нітрату срібла випадку бути вказаний. Фосфіду алюмінію, фосфід цинку води, що утворюються PH3, використовувані як зерносховища інсектицид фумігації. PH3 розчинність у воді набагато менше, ніж NH3 (відсутність водневих зв'язків), аміаку становить близько 1/2600, і тільки злегка розчиняються у воді була лужний, значно слабкіше, ніж NH3. Це важко сформувати фосфонію (PH4 ) сіль, тільки щодо суперкіслоту роль (наприклад, HI, HClO 4) отримували фосфонієві солі (наприклад, PH4I). PH4I повний гідроліз води, PH3 і HI, фосфонієві іони не перебувають у водному розчині. PH3 самозаймання у повітрі, це не легко, але загальна PH3 містять P2H4, запалить PH3 (температура самозаймання близько 423.2K). PH3 сильним відновлювальним срібла наводимо, іони міді: PH3 AgNO3 6 3 H2O ==== 6AG H3PO3 6 HNO3 PH3 8CuSO4 4H2O = H3PO4 4H2SO4 4Cu2SO4 6CuCl 2 PH3 ==== 2Cu3P 6 HCl 8CuCl PH3 4 H2O ==== H3PO4 8 8 HCl Cu Фосфіни Фосфін молекула деякі або всі атоми водню гідрокарб-заміщених органічних сполук тривалентного фосфору. Може бути розділений на фосфін RPH2, два і три фосфін фосфін R2PH R3P категорій. Смердючий і токсичних фосфіну. Хімічні властивості атома фосфору неподіленої пари електронів тісно пов'язані з природою і амін число подібних, з нуклеофільних реагентом і підставою продуктивності. Як фосфін атом має великий іонний радіус і низькою електронегативності, стеріческіх утруднень перехідного стану вона має невеликий ефект нуклеофільного фосфін більше, ніж відповідні азотовмісні сполуки. Фосфіну і вторинні фосфінової рівень нижче, ніж відповідне основне з'єднання азоту, який пов'язаний з атомом фосфору неподіленої пари орбітальних електронів мають більше функцій з, і неподіленої пари електронів атома азоту є sp3-орбіталі, легко комбінації з протоном. Крім того, процес фосфін протоновані розчинник ефект є слабким. В якості атома фосфору в валентну оболонку електронів 10, так що такі з'єднанням тривалентного фосфору, має електрофільного, батьки та інші характеристики спорідненості диенов. Фосфін багатьох реакцій фосфору утворюють міцну зв'язок (Р = O) є рушійною силою. Три фосфін сприйнятливі до окислення повітрям оксиду тріалкіл фосфін, фосфін, такий як метил фосфонат MePH2 в повітрі може бути спонтанним; трифенілфосфіну стійкий на повітрі, але може бути окислювачів. Симетричний тріалкілфосфіна зокрема, трифенілфосфін ліганд є хорошим, легко і перехідних металів з утворенням фосфату металу зв'язком, такі комплекси розчиняються в органічних розчинниках можна використовувати в якості гомогенного каталізатора, фосфінової комплексу металу і характер рішення на σ зв'язок, зв'язок і π просторові труднощі. |
| Користувач Огляд |
|
Немає коментарів |