| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Вторинна структура |
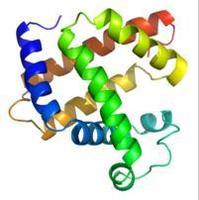 |
|
Технологія Визначення Китайська назва: дві структури Англійська назва: вторинна структура Визначення: поліпептидного молекули ланцюга або полинуклеотидной ланцюга уздовж осі, утвореної обертанням і складні, в основному, внутрішньомолекулярних водневих зв'язків, розташованих в локальному просторі. Якщо спіралі білка α, β лист, кут β, статистичний клубок, і ДНК подвійної спіралі.Прикладні науки: біохімії та молекулярної біології (теми), генеральний (два суб'єкта) Вище утримання Національного комітету науки і технологій оголосив затвердження Вторинна структура у минулому біологічних макромолекул на атомному рівні структуру визначені водневих зв'язків. Вторинної структури білка засновані на основній ланцюга водневих зв'язків між аміногрупами певним шаблоном, який визначається DSSP водню, не включаючи головну ланцюг і бічні ланцюга або між бічного ланцюга водневих зв'язків між ними. Вторинної структури нуклеїнових кислот на основі водневих зв'язків між основами визначено. У багатьох молекул РНК з вторинної структури РНК важливо нормальну функцію, а іноді навіть важливіше, ніж послідовності. Це може допомогти для аналізу некодуючих РНК. Вторинної структури РНК можуть бути використані для підвищення точності прогнозу комп'ютер. У той час як інші програми біоінформатики буде використовувати деякі поняття для аналізу вторинної структури РНК. План Дві структури в області біохімії і структурної біології, відноситься до біологічної макромолекули, такі як білки і нуклеїнові кислоти (ДНК або РНК), тривимірну формулу локального сегмента. Він не описує будь-якої конкретної позиції атома, які будуть розглядатися в третинної структурі. Деталі Оскільки водень був пов'язаний з іншими структурними особливостями, тому він визначає дві структури буде трохи менш формальним. Як білка спіралі, в інтенсивності комбінаційного ділянки проходять конкретній області, зазвичай за допомогою головного двогранні кути ланцюга. Таким чином, з цього розділу двогранного кута буде називатися "спіраль", незалежно від того, це реальна зв'язок. Інші трохи менше формальні визначення також були запропоновані, і мульти-кривої диференціальної геометрії є застосування концепції, такі як сума кривизни та кручення. У той час як найменш формальним, структурна біологія приділяти очі, щоб визначити і записати два атомного рівня структури. На вторинної структури біологічних макромолекул може бути оцінена спочатку спектру. Білки можуть бути використані для загального методу, називається довжиною хвилі ультрафіолетового світла (довжина хвилі 170 250 нм) кругового дихроїзму. У двох-208nm і 222nm найменше α спіральної структури можуть бути показані, і одним 204 нм мінімального або 207nm, відповідно, може відображати будь-яку форму або структуру β листа. Менш поширеним підходом є інфрачервона спектроскопія, яка може виявити водневих зв'язків через шоку, викликаного аміну. Нарешті, вторинна структура може бути точно зі зрушенням ЯМР хімічні оцінюється. Білок Вторинна структура білка між залишки, що містять частково регулюється взаємодія водневих зв'язків. Два найбільш поширених структури α-спіралі і β-кратний, на додаток до β-повороту і статистичного клубка. Після обчислення в інших спіралі і π, такі як спіральні котушки 310, енергія зразок водневого зв'язку зі сприятливим, але спіраль у природний білок дуже рідко, щоб бути невигідним в центральній упаковка спіралі каркас α , виявили лише в кінці. Тупики, випуск і гнучке кільце пов'язано більше "звичайних" вторинної структури. Довільної форми насправді не вторинну структуру, але це свого роду відсутність регулярних вторинних форм структури. Амінокислоти на формування різних вторинна структура має іншу ємність. Проліну і гліцину з'явиться в кутку, а можна згорнути α форму спіралі правила скелета, але два не було нормальної можливості морфології. У спіральну форму в білку амінокислот метіонін, аланін, лейцин, глутамінової кислоти і лізин (амінокислоти одного числа буква "МАЛЕК"); Навпаки, у великій ароматичних залишків (Trp, тирозин і фенілаланін) і cz У розгалужених амінокислот (ізолейцин, валін, треонін і) використовується β складеному стані. Однак, якщо послідовність одна, цього не достатньо, щоб скласти надійний спосіб прогнозування вторинної структури. Число DSSP є "Визначити Вторинна структура білків" акронім, який є формальним серії статей перераховані відомі тривимірну структуру вторинної структури білка. DSSP номер зазвичай використовується для опису однієї літери вторинної структури білка. Вторинна структура заснована на моделі водневого зв'язку вказати. * G: 3 Кутові спіралі (тобто 310 спіралі). Мінімальна довжина трьох залишків. * H: 4 кут нахилу (α спіралі). Мінімальна довжина чотирьох залишків. * I: 5 Corner спіраль (спіраль π). Мінімальна довжина п'ять залишків. * T: водень кута (кут 3, 4 або 5). * E: паралельний згин β та / або анти-паралельно складаний формі (розширена ланцюг). Найкоротша довжина 2 залишків. * B: Незалежна залишків β в міст (β пару раз зв'язок) * S: вигин (тільки не водневими зв'язками вказаний) Всі ці форми не є залишком з пробілами в DSSP вказані, а іноді ставить представляти C або L представляти ротор кільце. Спіралі (тобто G, H і I) і складеної формі вимагає певної довжини. Це тягне за собою два сусідніх в первинній структурі залишку водневих зв'язків, щоб сформувати за тією ж схемою. Якщо гвинт занадто короткий або складену водень моделі Т-або В, відповідно, буде закодований. Які були й інші білки вторинної структури числа, але менше використання. Білки передбачення вторинної структури Ранні білок вторинний метод передбачення структури на основі амінокислот, як правило, форму спіралі або складені, а іноді і необхідно, разом з утворенням вторинної структури приблизно способи використання енергії. Ці методи прогнозування залишок три стани (спіраль, складені або скручені) може становити близько 60% точністю, використання декількох точністю вирівнювання послідовностей може бути збільшена до 80%. Множинне вирівнювання послідовності амінокислот в змозі знати повну позитивного розподілу (в тому числі в безпосередній близькості від місця, як правило, на кожній стороні 7 залишків), і еволюції структури до більш чітке зображення. Наприклад, у місцях, гліцин білка сама заявила, що вона є довільної форми. Однак численні порівняння послідовностей можуть бути знайдені в майже один мільярд років після еволюції 95% білка, що є сприятливим гвинтовий амінокислот. Крім того, якщо в цьому положенні для визначення середньої гідрофобність, також виявили, що розчинна залишок відповідно до α спіралі. Взяті разом, ці фактори припускають, що гліцин у межах вихідного білка α спіральної структури, а не довільної форми. Різні методи будуть об'єднані з існуючими даними, щоб сформувати передбачення з трьох станів, ці методи нейронних мереж, прихованих марковських моделей і опорних векторів. Сучасні методи прогнозування можуть бути передбачити в кожному положенні результати дають впевненість бали. Вторинні методи передбачення структури були відкалібровані постійно, наприклад, EVA експерименту. На основі близько 270 тижнів тестування, найбільш точний метод, який буде PSIPRED, SAM, Портер, професор і соболя. Цікаво, що в ряді способів, щоб знайти консенсус або те ж саме, і не може підвищити їх точність. Найбільше поліпшення, здається, в β акції передбачити, тому що метод використовується для ігнорування деяких з β сегменти акцій. У цілому, найвища точність передбачення може бути тільки до 90%, за природи DSSP стандартний метод, на відміну від пророкування і калібрування. Точно передбачив передбачення вторинної структури в три структури є важливими елементами. Наприклад, певний βαββαβ вторинної структури моделі, є ознакою ферредоксин. Нуклеїнова кислота |
| Користувач Огляд |
|
Немає коментарів |