| Мова : |
|
| Енциклопедія співтовариство |Енциклопедія відповіді |Відправити запитання |Словник знань |Завантажити знання |
Складаний білок |
 |
|
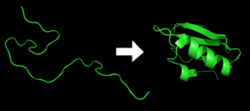
Основна одиниця білок амінокислот і білків належить до первинної структури амінокислотної послідовності білка амінокислотних залишків, що містяться в гідрофільні, гідрофобні, позитивно заряджені, негативно заряджених залишків через ...... і т.д. Характеристики Взаємодія між тривимірної скласти в третинної структурі. Незважаючи на те, білок може бути структурована протягом короткого часу з тривимірною структурою руйнування, що дослідники не могли протягом короткого часу розраховується виходячи з амінокислотної послідовності білкової структури, навіть не міг отримати точну тривимірну структуру. Таким чином, дослідження білка процес складання, можна сказати, розшифрувати "другий генетичний код" - складений пароль (складаються код) процесу.Передмова Структура визначає функцію, просто знаючи послідовність генома не робить нас повністю зрозуміти функції білків, але не знаю, як вона працює. Білкових взаємодій в клітці середовище в силу (конкретні рН, температура тощо) під власним зібрати самостійно, це процес самозбірки називають згортання білків. Проблема Білка складні вказаний як "21-го століття біофізика" важливе питання, це центральна догма молекулярної біології невирішених основних біологічних проблем. Із серії прогнозування третинної структури білкових молекул і передбачити подальший його функцій, є складним завданням. Білка складні, особливо на початку процесу складання, що зароджується процес складання пептид є всеосяжне й остаточне правило роз'яснює центру є фундаментальною проблемою у цій галузі в останні роки, нових відкриттів на зростаючого пептиду може мимоволі рази традиції вніс фундаментальний концепція корекції. Серед них рентгенівської кристалографії і різні спектроскопічні методи та електронної мікроскопії відіграє надзвичайно важливу роль. Тринадцята міжнародна конференція з біологічної фізики, лауреат Нобелівської премії Ernst підкреслюється в доповіді, ЯМР використовується для вивчення білків основною перевагою є те, що це надзвичайно детальне вивчення кінетики молекул білка, а саме динамічною структурою або структурами Фізичні вправи і білкові молекули функціональних відносин. ЯМР методи були в змозі уявити другий пикосекундного тимчасової області структури білків спостерігали по руху, в тому числі рух основну ланцюг і бічні ланцюги, і при різних температурах і тиску білка згортання і розгортання. Високомолекулярні структури білка аналіз також не тільки вирішити конкретну структуру, але більше уваги флуктуації структури і руху. Наприклад, транспортний малих молекул і білків зазвичай присутні ферменти двох конформаціях зв'язування ліганда і незв'язаного ліганду. Структура конфігурації, наприклад, коливаннями конформаційні прелюдія переходу необхідно, що вимагають спектроскопії, спектроскопії і рентгеноструктурного аналізу структури в поєднанні з балансом коливання, конформаційних змін і змін під час формування різних проміжний стан , і якщо для того, щоб зрозуміти, як білки згортаються, ви повинні знати кілька основних процесів складання тимчасових масштабів і механізмів, у тому числі вторинної структури (спіральні й складні) освіта, кучеряве, далеких взаємодій і розгорнув пептиду колапсу. Різні методи використовувалися для вивчення вторинного процесу, такі як ЯМР швидко, швидко спектроскопії (флуоресценція, далекого УФ та ближній УФ КД). Аналітичні огляди Ін віво біологічними інформаційний потік може бути розділений на дві частини: першу частину зберігається в ДНК-послідовності транскрипції і трансляції генетичної інформації, переданої через первинну послідовність білка, який передається між одновимірної інформації, потрійні Sub пароль, який опосередковує процес передачі; друга частина пептидного ланцюга через гідрофобний колапс, обмотка простір, що складається бічного ланцюга з утворенням агрегації нативної конформації білка, в той час доступу до біологічною активністю, і, отже, біологічної інформації вираження, білок вектором експресії, як біоінформації, яке формується складений просторову структуру, яка має специфічну біологічну функцію, засновану, тобто одновимірного до тривимірного інформаційне повідомлення процесу перетворення необхідно показати життєздатність. З 1960-х Анфінсен скорочення засноване на денатурований РНКази бичачої підшлункової залози без допомоги будь-якого іншого речовини, тільки після видалення денатуруючих і відновлюють агентів, щоб відновити природну структуру на експериментальних результатах, запропонував "поліпептидного ланцюга амінокислотної послідовності містить термодинамічно стабільну форму нативну конформацію всю необхідну інформацію »,« самосборка теорії ", поряд з правом проводити великі дослідження згортання білка, згортання білків людей теорія була доповнена і розширена. Анфінсен з "самосборки термодинамічних гіпотеза" багато в пробірці експерименти показують, що дійсно існує багато білків в пробірці може бути оборотною денатурації і повторного укладання, особливо невеликі рние білки, але не всі білки так. І в зв'язку з особливими екологічними факторами, в природних умовах згортання білка далеко не так. Згортання білка часто вимагає участі інших кофакторів і супроводжується гідролізу АТФ. Таким чином, в 1987 році Елліс пропонованої згортання білка "допоміжні доктрини зібрань». Це означає, що процес згортання білка не тільки термодинамічні, мабуть контролюється кінетики. Деякі вчені мають деяку схожість на основі амінокислотної послідовності білка з різними складчастої структури, а інший амінокислотної послідовності ряду різних структурно подібних явищ була запропонована як мРНК вторинної структури можуть впливати на структуру білка генетичного коду і, отже, гіпотеза . Але до цих пір ця гіпотеза не має жодних експериментальних доказів того, всього в декількох чисто математичних аргументів [3]. Таким чином, послідовність амінокислот, як саме для визначення просторової конформації це? Навколо цієї проблеми вчені провели багато хороших робіт, але до цих пір наші знання про механізми згортання білка ще не завершений, і навіть деякі аспекти, Є ще неправильна точка зору. Зробити важливий внесок в цьому відношенні типовим прикладом є США CB Анфінсен дослідницької групи з денатурації рібонуклеази бичачої підшлункової залози і укладку досліджень. Рібонуклеази бичачої підшлункової містить 124 амінокислотних залишків з восьми пар складається з чотирьох пар тіол дисульфідних зв'язків. Можна обчислити молекули ферменту 8 тіольний дисульфідні зв'язку складається з чотирьох можливих способів існує 105 видів, яка забезпечує кількісну оцінку склав рекомбінантних показників. У м'яких лужних умовах, концентрація 8 моль сечовини і меркаптоетанол великий чотири дисульфіди можуть повністю відновити всю молекулу стає статистичний клубок, як, денатурованого ферменту. Діалізу для видалення сечовини в присутності кисню, утворення дисульфідних зв'язків знову, повне ренатурації молекули ферменту, тіол дисульфіду в парі з тією ж природно, складні молекули можуть бути натуральні кристалічні кристали ферменту і з тією ж рентгенівського дифракційної картини, які підтвердили, що молекули ферменту в процесі повторного укладання, не тільки може спонтанно повторного укладання, і вибирати тільки 105 видів дисульфідних зв'язків в одне можливе з'єднання. Теоретична модель Рамкова модель (Рамок моделі) Рамок моделі [4] гіпотетичний білок конформаційні залежить від часткової амінокислотної послідовності. Складання поліпептидного ланцюга, початковий етап процесу, швидке формування першої стабільної елементів вторинної структури, звані "мерехтіння кластер", потім вступають в контакт з вторинної структури, так, щоб утворити стабільну вторинну каркасну структуру, і, нарешті, вторинної структури кожен кадр сплайсингу, поступово жорсткість пептидного ланцюга, формування третинної структури білка. Ця модель передбачає, що навіть невеликі молекули білка може також бути частиною відкидний частиною, при формуванні субдоменів важливо структур проміжних сполук. Гідрофобні модель колапсу (Гідрофобні модель колапсу) Гідрофобні модель колапсу [5], гідрофобні взаємодії вважається в процесі складання білка зіграло вирішальну роль в силу фактора. У формуванні будь-якого вторинної структури та третинної структури скоро до першої появи неспецифічних гідрофобних краху. Дифузія - Зіткнення - склеювання механізмом (Дифузія Зіткнення-моделі спайки) Модель передбачає, що згортання білка стрейч починаючи з декількох сайтів в точках ланцюга пептиду в ході таких сайтів в елементи вторинної структури або летючі гідрофобних кластерів в основному покладатися на місцевих послідовність процесів або середньої (3-4 залишків) взаємодій в обслуговуванні. Вони не є особливим чином дифузії броунівський рух, зіткнення, зчеплення один з одним, в результаті чого велика покоління структуру і, отже, підвищену стабільність. Подальше формування гідрофобною серцевини і зіткнення вторинну структуру класу розплавленої глобули стан проміжних сферичну структуру. Проміжні скориговані щільних сферичних, ненатуральних-подібну активність високо впорядковану структуру розплавленої глобули державної структури. Нарешті неактивних високоупорядоченних стан розплавленої глобули в повному динамічному природному стані. Зародження - конденсація - модель зростання (Ядерна-конденсації моделі зростання) Відповідно до цієї моделі, пептидного ланцюга можуть бути сформовані в області «складка ядер" до них в якості основного, а потім складати пептидного ланцюга продовжує отримувати природний конформації. Так зване "ядро" насправді спеціальні амінокислотні залишки утворюють схожі на природному стані взаємодії структуру мережі, ці залишки не в неспецифічних гідрофобних взаємодій в обслуговуванні, а специфічну взаємодію цих залишки утворюють щільно упаковані. Складні формування ядра лімітуючої стадії початковій стадії. Накладення моделі (Координатно-пила головоломки модель) Ця модель [9] є поняття кілька поліпептидних ланцюгів, можуть бути різними за складаний шляху, кожен шлях уздовж складчастої структури процесу є більш природно, може в кінцевому рахунку утворюють природну конформацію, і уздовж кожної складаний шлях високою швидкістю в порівнянні з одним складаний шляху, поліпептид швидкість ланцюга, з іншого боку, зовнішні умови, фізіологічні чинники, такі як невеликі зміни або мутації в одному складаний шлях може дати більш сильний вплив, і , що має безліч складних шляху, ці зміни можуть бути доведені до впливати на складаний шляху смуги, але не впливає на інші складаний шляху, і, отже, не буде заважати поліпептидного ланцюга від загальної складання змін не викликало, якщо ці фактори занадто великий, щоб принципово вплинути на складаний поліпептидного ланцюга. Решеточной моделі Решітка моделі (також згадується як модель HP), вперше був використаний кропу та ін в 1989 році. Решітка моделі можна розділити на два типи двовимірної моделі і тривимірної моделі. Двовимірна модель решітки генерується в просторі в площині, перпендикулярній до одиниці довжини сітки, кожна з амінокислот в послідовності сортування порядку, щоб вони знаходилися на точці перетину сітки, в послідовність суміжних амінокислот при приміщенні в сітці повинні бути суміжними, сусідні амінокислот в моделі решітки, відстань дорівнює 1. Однак слід зазначити, що кожен перетин в сітці можуть бути розміщені на одній молекули амінокислоти, якщо послідовність амінокислот у молекулі вже були поміщені в цьому положенні, то після послідовності амінокислот не можуть бути розміщені в цьому сітки. Випадку, якщо розміщення амінокислот сталися під час поточної молекул амінокислот для розміщення ніякої позиції не можуть бути розміщені, і це показує, що ця конфігурація є необгрунтованим, необхідно змінити. 3D модель точки сітки і двовимірну сітку модель схожість, яке виробляється в тривимірному просторі, тривимірні сітки одиницю довжини. Сітка молекул амінокислот розміщені таким же чином і двовимірні, але в двовимірної моделі решітці молекул амінокислот при приміщенні протягом перших двох амінокислот на додаток до послідовності, тільки зовні до трьох напрямках, може бути обраний, і в тривимірному складність модель решітки Ступінь став набагато краще, розміщення молекул амінокислот може мати до п'яти додаткових напряму. Шаперонів 1978, Laskey гістонів і ДНК при фізіологічній іонної сили в лабораторних експериментах було виявлено, що необхідність мати ядерний кислий білок --- ядерний якості (нуклеоплазміна) існує два тіла можуть бути зібрані в ядрі, або опадів випадає. Відповідно Laskey називають "молекулярної шаперонами". Молекулярна шаперонів є здатність зв'язувати і стабілізації білка в іншу конформацію нестабільним, і за рахунок поєднання контролю і випуску сприяти нові поліпептидні ланцюга складаний складання або деградації мультімерной білка і транспортних клітинна мембрана клас білків [10,11]. Молекулярні функції шаперону визначено, де білок, що має такої функції є молекулярних шаперонів, їх структура може бути зовсім різними. Ця концепція була поширена на багатьох білків, супроводжуючих були визначені головним чином належать до трьох високо консервативних білків сімейства [12]: стрес 90 сімей, 70 сім'ї стрес, стрес 60 сім'ї. Відрізняється тим, що стрес 60 сім'ї присутній в мітохондріях еукаріотичних (у ссавців називається Hsp58), хлоропласти (так званий cpn60), в цитоплазмі прокаріотів, це називається GroEL. Значення |
| Користувач Огляд |
|
Немає коментарів |